収支の考え方
収支は化学工学特有の考え方です。
質量保存の法則やエネルギー保存の法則に則り、投入したエネルギーが何に使われ、物質がどこに移動しているかを把握します。
その際に収支計算を行い、物質収支計算書や熱収支計算書としてまとめられます。
主に使われる数値として流量や濃度、組成、温度、圧力が挙げられます。
収支の式
収支の式は、ある限定された範囲や時間において入れた物質やエネルギーの量に対して出ていく量が等しくなることが基本です。
- 入れた物質の量=出た物質の量
- 入れたエネルギーの量=出たエネルギーの量
ここに反応で生成した新たな物質の量や反応熱が追加されます。
- 入れた物質の量=出た物質の量+反応生成物の量
- 入れたエネルギーの量=出たエネルギーの量+反応で生成したエネルギーの量
更にプロセス内に残る量を考えます。
製造工程によっては流入した物質やエネルギーは全て排出されるわけではなく、系内に蓄えられるものも多く存在します。
- 入れた物質の量=出た物質の量+反応生成物の量+系内に蓄積した物質の量
- 入れたエネルギーの量=出たエネルギーの量+反応で生成したエネルギーの量+系内に蓄積したエネルギーの量
最後にロスの考えが含まれます。
例えば熱が大気に逃げてしまう(放熱)、配管のフランジから液体が漏れてしまう、流体と配管壁面との摩擦によりポンプの送液圧力が下がる(圧力損失)といった内容が挙げられます。
- 入れた物質の量=出た物質の量+系内に蓄積した物質の量+反応生成物の量+ロス量
- 入れたエネルギーの量=出たエネルギーの量+系内に蓄積したエネルギーの量+反応で生成したエネルギーの量+ロス量
バッチ製造と連続製造での違い
バッチ製造は装置内の内容物を毎回全て入れ替える運転方式です。
1サイクルごとに中身が全て入れ替わるため物質やエネルギーの出入り量は把握しやすくなっています。
対して連続製造は一定速度で連続的に操作する運転方式です。
連続製造においてはバッチの区切りがありませんが、時間あたりの出入り量として考えることで収支計算できます。
物質収支
化学プロセスにおいては反応工程を基準として前工程と後工程を考えます。
前工程では「原料の調製」を、後工程では「分離・精製」を主に行います。
そのため物質収支は反応前後工程の物理的な収支も考慮します。
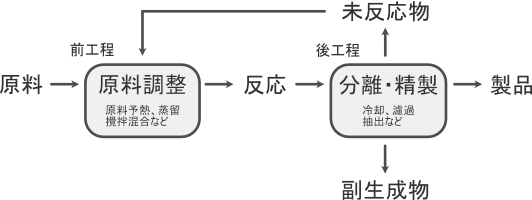
物理的な物質収支
化学プロセスにおいては物理的なプロセス、つまり反応の前後工程が多くを占めます。
例えば単位操作として蒸留や濾過、吸収、吸着、抽出などが挙げられます。
これら単位操作を経るごとに物質収支がどのように変化するのかを整理しなければなりません。
特に流体においては連続の式が成り立つため、連続した配管の中での質量流量は一定になります。
そのため物質収支は体積流量ではなく質量流量で表現されます。
化学的な物質収支
化学反応を伴う場合は成分そのものが変化するため、反応特有の条件も考慮しなければなりません。
例えば反応率や収率が挙げられます。
- 反応率:供給した原料がどれくらい消費されるか?
- 収率:供給した原料に対してどれくらい目的物が得られるか?
化学反応を考えるため、基本単位は時間あたりの物質量(mol/hなど)が使われます。
更に前後で物理的な操作が加わるため、操作する温度や圧力も考慮して質量流量に換算して利用する場合もあります。
また反応に伴い投入した物質量(mol)の合計と生成した物質量の合計は異なることに注意が必要です。
例えば水の反応式は2H2+O2→2H2Oですので、2molの水素と1molの酸素(合計3mol)から2molの水が生成します。
エネルギー収支
化学反応では発熱や吸熱を伴います。
温度維持するためにも加熱冷却のプロセスが必要となり、エネルギー収支を計算しなければなりません。
また目的の物質収支を達成するために流体が持つ位置エネルギーや圧力エネルギーなども考慮します。
基本単位は時間あたりの熱量(J/hなど)です。
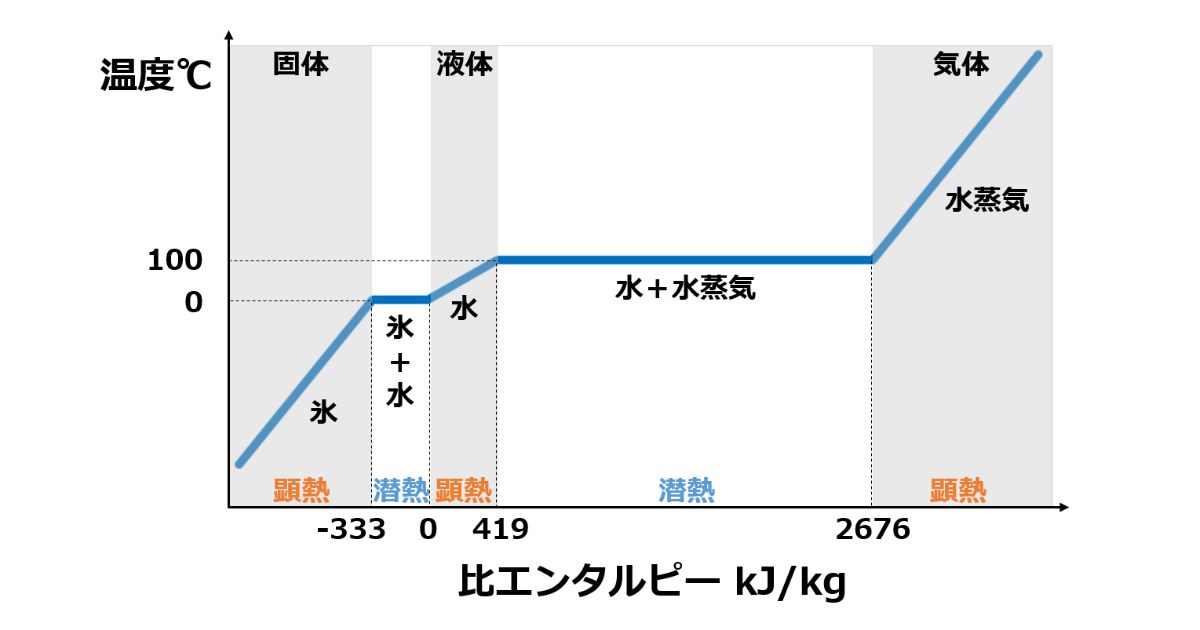
潜熱と顕熱
与えられた熱を何に使うのかは潜熱と顕熱で大きく分けられます。
潜熱は蒸発や凝縮のように状態変化する時に必要となる熱です。
対して顕熱は温度上昇のように物質が温度変化する時に必要となる熱です。
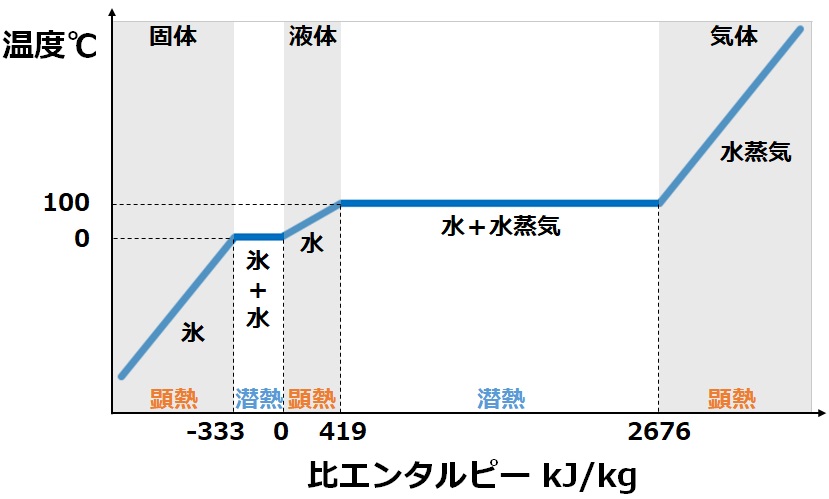
比熱
ある物質1kgを1℃上昇させるために必要な熱量を比熱と呼びます。
また1molの物質を1℃上昇させる場合はモル比熱です。
つまり比熱が小さい場合は加熱しやすく、比熱が大きい場合は加熱しにくいことを表します。
扱う化学物質の比熱が分からなければ必要な熱量を見積もることができません。
調べても値が見つからない場合は化学構造式から推算しなければなりません。
熱の移動方式
熱の移動には対流伝熱や伝導伝熱、放射伝熱の3種類が存在します。
- 対流伝熱:流体の流れにより熱が移動
- 伝導伝熱:物質の移動が無く熱のみが移動
- 放射伝熱:高温物質から出る熱放射線によって熱が移動
特に混合が難しい流体も多いことから、熱交換器を用いた伝導伝熱が頻繁に採用されます。
流動に関するエネルギー収支
配管内においてはベルヌーイの定理を基本として収支を考えます。
ベルヌーイの定理は位置エネルギーや圧力エネルギー、速度エネルギーの和が一定になることを示したものです。
ベルヌーイの定理[J/kg]$$gz+\frac{P}{\rho}+\frac{ \ u^2 \ }{2}=一定$$ρ:密度[kg/m3]、g:重力加速度[m/s2]、z:高さ[m]
P:圧力[Pa]、u:速度[m/s]
ベルヌーイの定理は理想流体であること、つまり非粘性である場合に成り立ちます。
ただし実際は流体の粘性により管内摩擦が発生したり、配管継手部分にて渦によるエネルギー損失(圧力損失)が発生したりします。
ポンプなど外部からの動力供給、移送に伴う圧力損失を考慮して機械的エネルギー収支式を求めます。
機械的エネルギー収支式[J/kg]$$gz_1+\frac{P_1}{\rho}+\frac{ \ u_1^2 \ }{2}+W=gz_2+\frac{P_2}{\rho}+\frac{ \ u_2^2 \ }{2}+F$$ρ:密度[kg/m3]、g:重力加速度[m/s2]、z:高さ[m]
P:圧力[Pa]、u:速度[m/s]、W:外部動力[J/kg]、F:圧力損失[J/kg]
オススメ書籍
・反応工学
反応工学や触媒化学を学ぼうと思ったらこの書籍です。
これを読めば基礎は十分身に付きます。
そして何より例題や演習問題、解答解説が十分に盛り込まれている点もオススメできる理由です。
-

-
反応工学
www.amazon.co.jp
・化学工学ー解説と演習ー
化学工学を勉強したい!と思ったら真っ先にオススメしたい書籍です。
他の汎用化学工学書籍には無い「撹拌動力計算」や「撹拌伝熱計算」も記載されています。
-

-
化学工学―解説と演習ー
www.amazon.co.jp
・化学プラント配管設計の基本
伝熱の種類、熱伝導の計算、熱交換器の種類について記載されています。
その他、化学工学の基本事項が解説された後、それらを踏まえて化学プラントにおける配管設計の基礎から詳細に解説される書籍です。
この1冊で配管設計を一通り勉強できます。
-

-
化学プラント配管設計の基本―配管技術者への道しるべ
www.amazon.co.jp