物質が状態変化に関する熱には潜熱と顕熱の2種類があります。
物質の状態変化に必要となる熱を潜熱、温度変化に必要となる熱を顕熱と呼びます。
| 項目 | 潜熱 | 顕熱 |
|---|---|---|
| 意味 | 物質の状態変化に伴う熱 | 温度変化に伴う熱 |
| 温度変化 | なし | あり |
| 例 | 氷が溶ける時の熱、水が蒸発する時の熱 | 水を温める時の熱、水を冷やす時の熱 |
潜熱の「潜」は潜在を意味し、この熱エネルギーは物質の中に隠れるように存在し(潜在化する)、温度計では直接測定できません。
顕熱の「顕」は顕在を意味し、この熱エネルギーは温度変化という形で目に見える(顕在化する)形で現れます。
(前提知識)物質の状態変化
例えば氷が水や水蒸気へと形を変える時、状態変化(もしくは相変化)が起きていると表現します。
固体、液体、気体、それぞれの変化の向きによって現象に対する名称が変わります。
- 融解:固体から液体への変化(氷が水になる)
- 凝固:液体から固体への変化(水が氷になる)
- 蒸発(気化):液体から気体への変化(水が水蒸気になる)
- 凝縮:気体から液体への変化(水蒸気が水になる)
- 昇華:固体から気体への直接的な変化(ドライアイスが気体の二酸化炭素になる)
- 凝華:気体から固体への直接的な変化(二酸化炭素がドライアイスになる)
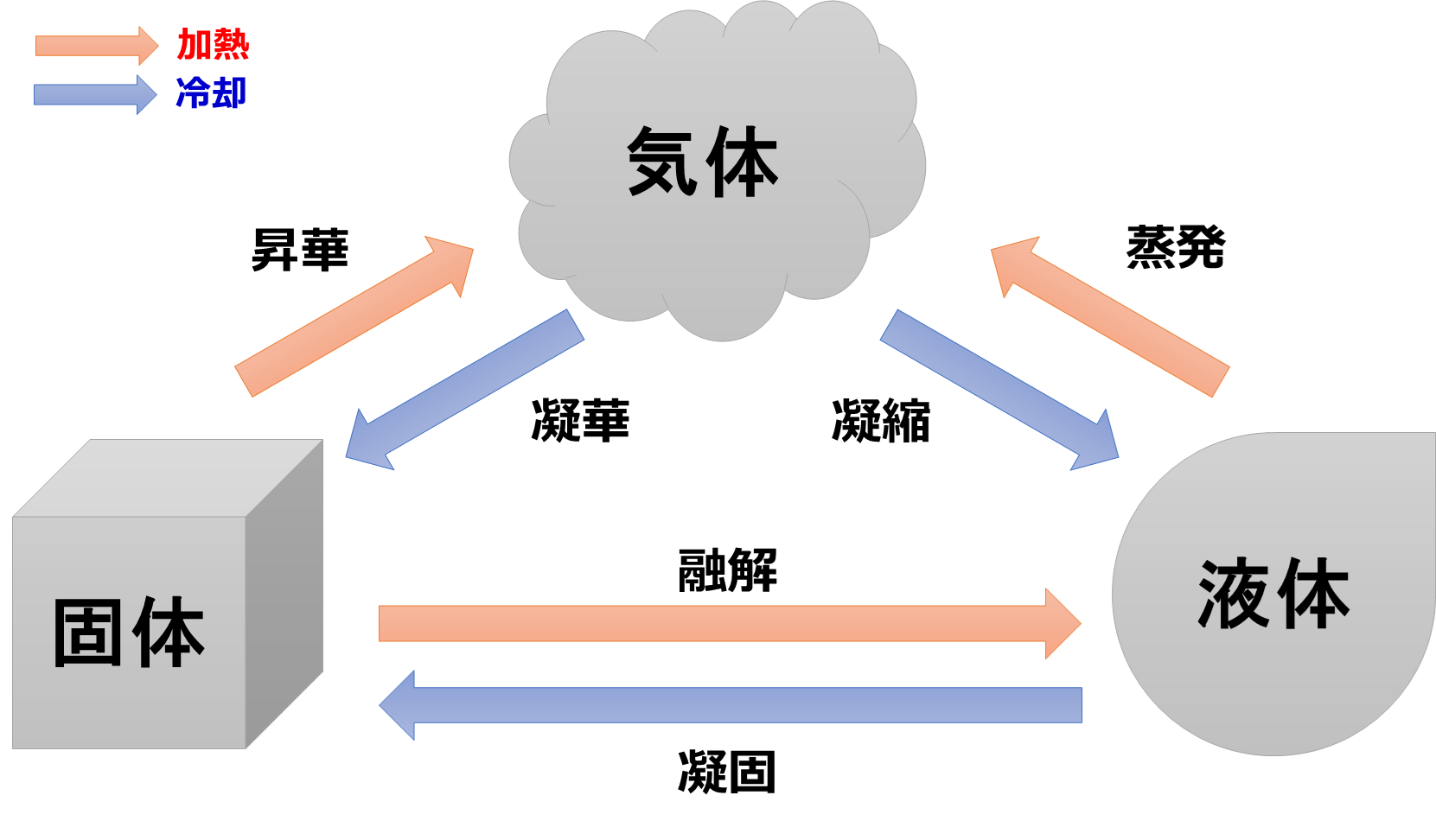
従来は、「固体から気体」「気体から固体」の状態変換はどちらも凝縮と呼ばれていました。
2022年度から日本の高校では、「気体から固体」への状態変化を凝華と呼ぶようになりました。
潜熱と顕熱とは
状態変化について理解したところで、潜熱と顕熱について基本的な内容を解説します。
潜熱は状態変化に必要な熱
潜熱は物質の状態変化に必要となる熱です。
温度変化に必要となる熱が状態変化に使われているため、潜熱変化が起きている時は温度変化が起こりません。
状態変化の種類によって蒸発熱(気化熱)、融解熱などと名称が変化します。
例えば水が蒸発する時は蒸発熱、氷が溶ける時は融解熱です。
顕熱は温度変化に必要な熱
潜熱は物質の温度変化に必要となる熱です。
例えば水を20℃から80℃へ温める時の熱を指します。
似た現象を表す要素に比熱があります。
比熱は加熱に必要となる物質固有の物理量で、比熱を用いることで必要となる熱量(顕熱)が求められます。
覚え方
潜熱と顕熱、覚える時は漢字の意味から考えます。
潜熱の「潜」は潜在を意味し、この熱エネルギーは物質の中に隠れるように存在し(潜在化する)、温度計では直接測定できません。
顕熱の「顕」は顕在を意味し、この熱エネルギーは温度変化という形で目に見える(顕在化する)形で現れます。
潜熱と顕熱の表現
潜熱と顕熱の違いが分かったところで、どのように表現するのかを解説します。
エンタルピー
潜熱や顕熱の熱量を定量的に表現する際、「エンタルピー」という概念が用いられます。
エンタルピーは物質が持つ熱エネルギーの総量を表す物理量で、簡単に言えば、「物質が持つ熱の量」と考えることができます。
潜熱や顕熱の熱量は、単位質量あたりのエンタルピーを表す比エンタルピー(kJ/kg)で表します。
ある状態間での比エンタルピー差を見ることで、その変化に必要な潜熱や顕熱が求められます。
水の例
水の顕熱を例に確認します。
氷に熱を加えると温度上昇が起こり、0℃に達するあたりから温度上昇が止まります。
その地点より氷から水への状態変化が起こっているため、熱を加えてはいるものの温度上昇がありません。
水を加熱して水蒸気にする過程も同様です。
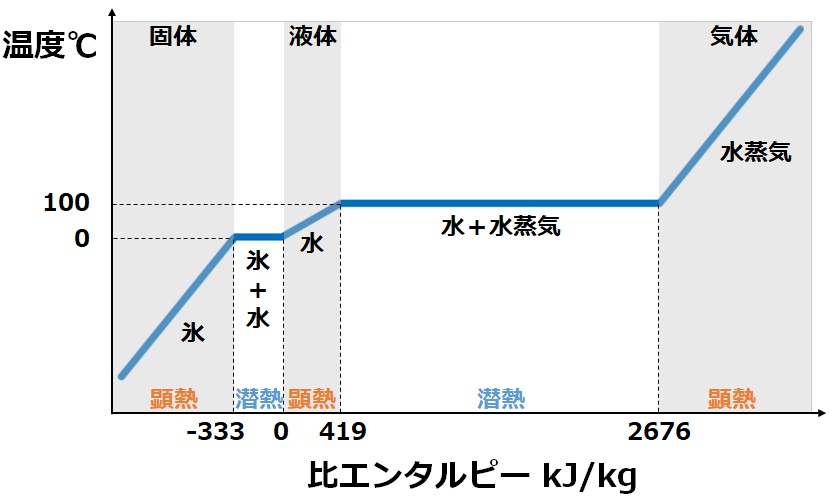
水1kgを0℃から100℃まで上昇させるのに必要な比エンタルピーは419 kJです。
そのため水の比熱は419 kJ/(kg・100K)であり、4.19 kJ/(kg・K)と求められます。
潜熱と顕熱の計算
それでは実際に潜熱と顕熱を用いて計算してみます。
潜熱の計算
状態変化に必要となる熱量(潜熱)を求めるには蒸発熱や凝縮熱など状態変化に応じた値を用います。
状態変化に必要な熱量
$$ Q=m×L$$
Q:状態変化に必要な熱量[kJ]、m:物質の質量[kg]
L:蒸発熱や凝縮熱[kJ/kg]
顕熱の計算
温度変化に必要となる熱量(顕熱)を求めるには比熱を用います。
比熱とは、物質1kgの温度を1K(=1℃)上昇させるために必要な熱量です。
温度変化に必要な熱量
$$ Q=m×c×\Delta T$$
Q:温度変化に必要な熱量[kJ]、m:物質の質量[kg]
c:比熱[kJ/(kg・K)]、ΔT:温度変化[K]
水の例で見る潜熱と顕熱
潜熱と顕熱どちらが実際に影響が大きいのでしょうか?
25℃の水1kg(=1L)を100℃の水蒸気に変化させる例を以下の条件で考えてみます。
潜熱には蒸発熱を、顕熱には比熱を用いて計算します。
- 蒸発熱:2,257 kJ/kg
- 水の比熱:4.19 kJ/(kg・K)
潜熱は2,257 kJ/kg×1kg=2,257 kJです。
顕熱は4.19kJ/(kg・K)×(100-25)K × 1kg=314 kJです。
今回の例ですと潜熱は全体の88%、顕熱は全体の12%と圧倒的に潜熱が大きくなります。
物質や条件によって変わりますが、物質を状態変化させるための熱量が非常に大きいことは意識しておく必要があります。
圧力による値の変化
潜熱と顕熱の値は、物質の圧力や温度条件によって変化します。
特に蒸気を扱う場合、圧力の影響は重要です。
蒸気圧力が高いとき、顕熱は増加し潜熱は減少します。
圧力が高くなると、分子間の距離が縮まり、分子の運動エネルギー(顕熱)が増加します。
一方で、高圧下では液体と気体の密度差が小さくなるため相変化に必要なエネルギー(潜熱)は減少します。
潜熱の応用:潜熱蓄熱材(PCM)
潜熱を利用した潜熱蓄熱材(PCM:Phase Change Material)は、一定温度で大量の熱エネルギーを蓄えることができる材料です。
主に固液間の相変化に伴う潜熱を利用して、熱エネルギーの吸収・放出を行います。
相変化中は温度が一定に保たれるため、温度制御が求められる応用分野で特に有用です。
代表的なものにパラフィンや硫酸ナトリウム十水和物などがあります。
これらは建築物の温度調整や、エネルギー効率の高い暖房・冷房システムに利用されています。
オススメ書籍
・化学工学ー解説と演習ー
化学工学を勉強したい!と思ったら真っ先にオススメしたい書籍です。
他の汎用化学工学書籍には無い「撹拌動力計算」や「撹拌伝熱計算」も記載されています。
-

-
化学工学―解説と演習ー
www.amazon.co.jp
・化学プラント配管設計の基本
伝熱の種類、熱伝導の計算、熱交換器の種類について記載されています。
その他、化学工学の基本事項が解説された後、それらを踏まえて化学プラントにおける配管設計の基礎から詳細に解説される書籍です。
この1冊で配管設計を一通り勉強できます。
-

-
化学プラント配管設計の基本―配管技術者への道しるべ
www.amazon.co.jp
・伝熱工学 (JSMEテキストシリーズ)
日本機械学会が出版する伝熱工学の解説書です。
幅広い分野を詳細に解説しているため、体形的に伝熱を勉強したい方にオススメです。
-

-
伝熱工学 (JSMEテキストシリーズ)
www.amazon.co.jp




