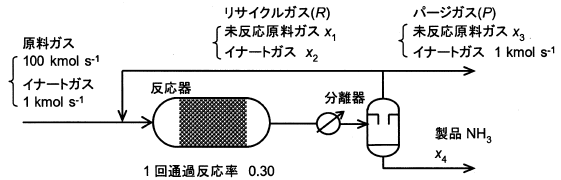
図のアンモニアプロセスは反応式がN2+3H2→2NH3であり、反応器の1回通過反応率は0.30とする。原料(N2とH2の1:3混合ガス)100 kmol/sにイナートガス(Ar、CH4)が1 kmol/s同伴される。このためパージ操作が必要である。このプロセス中の流量x1、x2、x3、x4[kmol/s]を下のプロセス図中のようにする。パージガスとリサイクルガスの組成は同じである。ここで、反応器の1回通過反応率が0.30なので、
(100+x1)(1-0.30)=x3+x1
である。パージガスとリサイクルガスの流量比率P:R=1:50のとき、リサイクルガスの流量R(=x1+x2)は以下のどれに近いか。
- 150 kmol/s
- 180 kmol/s
- 210 kmol/s
- 250 kmol/s
- 270 kmol/s
解答解説
正答は5番です。
パージ比率R:P=50:1のため、(x1+x2)=50(x3+1)です。分離器から出てくるガスを50:1で分配しているだけであり、リサイクルガスRとパージガスPの組成は同じです。そのため、パージガス中のイナートガスの組成1 kmol s-1に対し、リサイクルガス中のイナートガスの組成x2は50倍の50 kmol s-1となります。つまり(x1+50)=50(x3+1)で表せます。
上式および問題文に挙げられた(100+x1)(1-0.30)=x1+x3を用いてx1を求めると、219 kmol s-1となります。
よって、リサイクルガス流量R=x1+x2=219+50=269 kmol s-1、最も近い値は270 kmol s-1です。


